
为了探索 IPA@MC 在体内对结肠炎的保护作用,在小鼠中连续 5 天口服 IPA@MC、IPA 和 MC,然后在饮用水中通过葡聚糖硫酸钠 (DSS) 诱导结肠炎 7 天,如图 a。与健康组相比,观察到 DSS 组在 DSS 治疗后体重明显减轻。然而,接受 IPA@MC 的小鼠和健康小鼠之间的体重没有显着差异,表明 IPA@MC 显著保护小鼠免受 DSS 诱导的体重减轻(图 b)。此外,IPA@MC 组的疾病活动指数 (DAI) 趋势明显低于其他 DSS 治疗组(图 c)。除了体重减轻外,DSS 引起的结肠炎通常以结肠缩短和脾脏/体重比率增加为特征。在研究中,IPA@MC 组的结肠长度与健康对照组相当,显著长于 IPA、MC 和 DSS 组(p < 0.05,图 d)。此外,与 IPA 组和 DSS 组相比,观察到IPA@MC 组的脾脏/体重比率显著降低(p < 0.05,图 e),进一步证实了IPA@MC 在小鼠中的预防结肠炎的作用。通过苏木素-伊红 (H&E) 和促炎细胞因子的免疫组织化学染色检查结肠组织的炎症水平,包括白细胞介素-6 (IL-6) 和肿瘤坏死因子-α (INF- α )。结果发现,健康对照组和 IPA@MC 组的 H&E 染色图像没有显著差异,这与结肠中隐窝结构丧失、上皮损伤和免疫细胞浸润所反映的严重炎症反应形成鲜明对比,对于其他 DSS 治疗组(图 f)。此外,IL-6 和 INF- α的表达水平IPA@MC 组低于 IPA、MC 和 DSS 治疗组,表明 IPA@MC 改善了炎症。总之,这些结果表明,与单独使用 IPA 或 MC 相比,IPA@MC 对 DSS 诱导的小鼠结肠炎表现出强大的预防和治疗功效。

IPA@MC 对小鼠 DSS 结肠炎的保护作用
a) 动物研究设计示意图。IPA@MC 有望对 DSS 诱导的小鼠结肠炎产生强大的保护作用。b) 从第 0 天到第 7 天的体重变化。c) 从第 0 天到第 7 天的疾病活动指数 (DAI) 变化。d) 结肠长度和 e) 第 7 天小鼠的脾脏/体重比。f) 代表性 H&E 染色第 7 天结肠组织的图像。箭头表示炎症细胞浸润和上皮糜烂。将小鼠随机分为5组(对照:PBS+普通水;IPA@MC:IPA微胶囊+DSS水;IPA:IPA+DSS水;MC:空微胶囊+DSS水;DSS:PBS+DSS水)。
鉴于膳食益生元可以帮助调节结肠炎中的肠道健康,研究中选择了包括海藻酸盐、RS和壳聚糖在内的益生元作为后生元的载体。尽管 IPA 和 MC 组的结肠炎趋势均低于 DSS 组,但这些组之间没有统计学意义,表明单一的后生元或益生元的治疗效果不足。相比之下,与其他 DSS 治疗组相比,IPA@MC 组的体重减轻、DAI、结肠长度和脾脏/体重比均表现出显著差异,这表明 IPA@MC 中益生元和后生元之间的协同作用提供了一种更有效的预防和治疗结肠炎的治疗策略。这一结果可能归因于 IPA@MC 中益生元和后生元之间的协同作用。益生元主要是可被特定有益细菌利用的不易消化的寡糖。因此,肠道细菌代谢这些饮食成分以产生有益的代谢物(后生元),以维持健康的肠道菌群。相反,还表明,已知后生元可以增加有益细菌并抑制有害细菌的生长,从而进一步增加肠道中的益生元发酵。然后,由益生元喂养的有益细菌的丰度增加可以产生更高水平的后生元来维持健康的肠道。
随后,检测了门、目和属水平的肠道细菌组成,以研究各种治疗后结肠炎小鼠的分类学变化。如图c所示,拟杆菌门、厚壁菌门和变形菌门是所有组中检测到的主要细菌门。特别是,与 DSS 组相比,IPA@MC 组的拟杆菌门与厚壁菌门的比例与健康组相似,厚壁菌门丰度增加,拟杆菌门丰度降低(图d )。此外,与健康对照组相比,DSS 组在目水平上观察到分类学改变,包括增加的拟杆菌目和减少的弯曲杆菌目、梭菌目和丹毒菌目。与门水平的变化一致,IPA@MC 组的小鼠在顺序水平上与健康小鼠相似,而与 DSS 相比,DSS 诱导的 IPA 或 MC 小鼠几乎没有观察到变化组(图e)。接下来,在属水平上测量肠道细菌谱的进一步变化(图 f)。只观察到各组中顶级细菌属的适度变化。这一结果与之前的研究一致,即丰度较低的细菌类群可能在疾病发生中起重要作用。
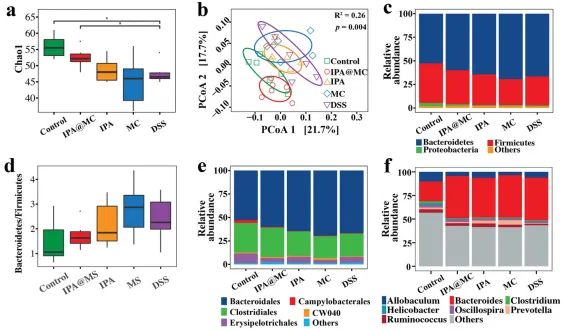
在结肠炎小鼠中使用 IPA@MC 调节肠道微生物群
a) 所有组中的 Chao1 丰富度。t检验用于检验组间的显着性。b) Bray-Curtis 距离的主坐标分析 (PCoA),显示IPA@MC 和 DSS-结肠炎组的健康对照组肠道微生物群的分层。通过置换多变量方差分析(PERMANOVA)确定统计显著性。在所有组中 c) 门水平中肠道细菌的相对丰度。d)所有组中拟杆菌门和厚壁菌门水平的比率。在所有组中,e) 顺序和 f) 属水平中肠道细菌的相对丰度。将小鼠随机分为5组(对照:PBS+普通水;IPA@MC:IPA微胶囊+DSS水;IPA:IPA+DSS水;MC:空微胶囊+DSS水;DSS:PBS+DSS水)。
产生 SCFA 的细菌类群的消耗也与 DSS 诱导的结肠炎和其他肠道疾病有关。进一步探讨了 PA@MC 是否可以增加口服后产生后生元的细菌的丰度。因此,通过线性判别分析效应大小(LEfSe)比较了所有组之间的差异肠道细菌属。在所有组中共观察到 17 个不同的肠道细菌属(图 a)。在差异分类群中,与健康小鼠相比,DSS 组描述了产生 SCFA 的细菌的相对丰度降低,包括Faecalibacterium 和 Roseburia(图 b,c)。有趣的是,IPA@MC 治疗可以显著增加结肠炎小鼠中产生 SCFA 的细菌的相对丰度。然而,在 DSS 组和单次 IPA 或 MC 处理后的组之间没有观察到这些属的丰度存在显著差异。该结果证实,与仅接受益生元的 MC 组或仅接受后生元的 IPA 组相比,IPA@MC 提供的益生元和后生元之间的协同作用可以增强健康肠道微生物群的恢复。
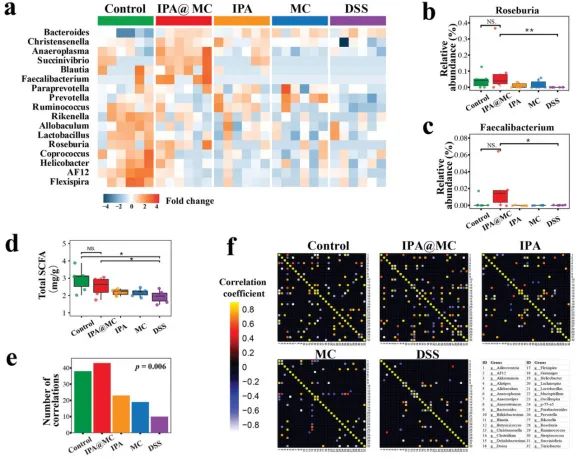
IPA@MC 改变肠道细菌和重建健康生态群落
a) IPA@MC 处理的小鼠肠道菌群发生改变,表明肠道微生物谱与健康小鼠高度相似。b,c) IPA@MC 处理的小鼠中产生短链脂肪酸 (SCFA) 的细菌属 ( Faecalibacterium和Roseburia ) 的相对丰度增加。通过线性判别分析效应大小(LEfSe)识别差异分类群。d) 与 DSS 组小鼠相比,来自 IPA@MC 处理的小鼠的盲肠样品中总 SCFA 水平增加。e) 肠道细菌属之间的相关性数量。通过卡方检验确定统计学显着性。f) 热图显示IPA@MC 组肠道细菌属之间的生态相关性高于 DSS 组。将小鼠随机分为5组(对照:PBS+普通水;IPA@MC:IPA微胶囊+DSS水;IPA:IPA+DSS水;MC:空微胶囊+DSS水;DSS:PBS+DSS水)。
与 IPA@MC 处理后产生 SCFA 的细菌属的丰度变化一致,发现与 DSS 组相比,IPA@MC 组的盲肠样品中总 SCFA 水平增加(图 d)。然而,SCFA 水平与Faecalibacterium 和 Roseburia丰度之间的相关性未能达到统计学显著性。大样本量和更深入的宏基因组学分析的进一步研究可能会在 IPA@MC 处理后提供 SCFA 表达和产生 SCFA 的分类群之间的证据。此外,我们分析了这些细菌属之间的相关性,以了解所有处理组之间的生态变化。发现 DSS 诱导的结肠炎小鼠与健康小鼠相比,细菌属之间的相关性数量较少(图 e,f)。相比之下,IPA@MC 组的显著相关性高于 DSS 组,表明 IPA@MC 有利于重建结肠炎肠道菌群的健康生态群落。以上结果表明,IPA@MC可以逆转肠道菌群的失调,从而对结肠炎产生显著的治疗效果。
注:文章译自Prebiotics and Postbiotics Synergistic Delivery Microcapsules from Microfluidics for Treating Colitis.
仅供学术参考。




