现代医学把人体看成是一个由不同“零件”组成的“机器”一样,把身体看作各个器官和系统的简单综合,认为每个器官系统都是独立于其它部分而发挥作用的。
然而,人体的器官系统都是相互联系和相互影响的,身体的各个器官系统并不是独立工作的。身体的每个器官都在与其它器官相互交流并影响着其它器官,肠道也不例外。事实上,肠道与我们身体的其它器官都有联系。因为肠道不仅仅是帮助我们消化食物和吸收营养,可以说肠道本身就是身体的健康中心[1]。
近期有研究进一步证实了“肠-眼轴”的存在,即肠道菌群失调可能与许多眼科问题的发生有所关联。本文将综述肠道微生物群和眼科问题的关系,包括自身免疫性葡萄膜炎、糖尿病性视网膜病变(DR)、年龄相关性黄斑变性(AMD)和原发性开角型青光眼(POAG)[2-3]。
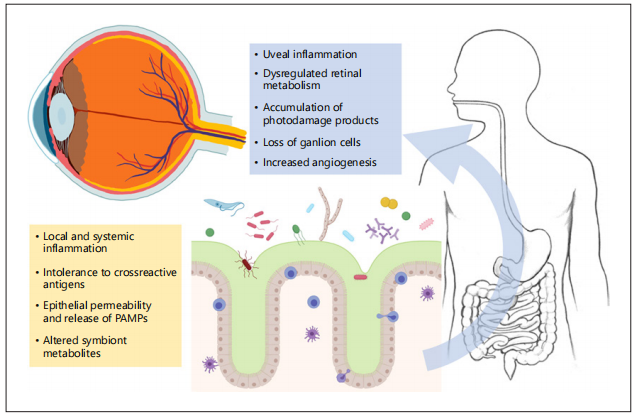
图示:肠道生态失调对眼睛直接和间接影响。
饮食、环境暴露、疾病或药物可能会导致口腔/肠粘膜上微生物群落的不适应变化,从而对眼部生理产生各种影响
自身免疫性葡萄膜炎
葡萄膜炎是发生于眼球内葡萄膜的一种炎症,通常与全身感染或免疫性疾病有关,主要表现是视力下降,可能伴有眼痛。青壮年和老年人均可发生,常反复发作,并可能会导致视力丧失。
葡萄膜炎患者的肠道菌群发生了明显的变化。在对人类粪便样本的研究中,葡萄膜炎条件下的肠道微生物多样性降低。对葡萄膜炎患者和健康对照组的肠道微生物进行基因测序发现,葡萄膜炎患者中瘤胃球菌属和颤螺菌属的丰度下降,另一项研究中,发现以抗炎特性而闻名的粪杆菌属、拟杆菌属、梭杆菌属和毛螺旋菌属在葡萄膜炎患者中减少,而普氏菌属增多。这些都表明,肠道菌群在自身免疫性葡萄膜炎的发病中发挥重要作用。
同时有大量研究也提到了关于肠道微生物群影响自身免疫性葡萄膜炎的作用机制,包括4种假设:
01. 微生物代谢物
肠道中的微生物能够产生许多代谢物,包括丁酸和短链脂肪酸,这些代谢物在炎症中具有保护特性。肠道微生物组成的改变可以降低有益的微生物代谢物的水平,加剧葡萄膜炎的炎症。
02. 肠道屏障的损坏
由于微生物失调导致的肠道屏障减弱可导致微生物的致病产物渗漏进入体循环。如脂多糖,可以落在葡萄膜中,并引起免疫反应,导致葡萄膜炎。
03. 肠道免疫稳态的失衡
辅助T细胞17(Th17)和T调节细胞的失衡导致白细胞介素-17(IL-17)的过量产生,激发炎症途径,使葡萄膜炎加剧。
04. 抗原拟态
即能够识别葡萄膜中自身抗原的T细胞在肠道中被微生物肽影响。
这些假设的机制在自身免疫性葡萄膜炎的发病机制中可能不止一种在起作用,因为它们并不是相互排斥的,而且反映了免疫细胞和肠道微生物失调的复杂相互作用。
糖尿病视网膜病变
糖尿病视网膜病变(DR)是一种由糖尿病引起的严重眼部问题,是世界卫生组织(WHO)公布的三大致盲眼科问题之一。早期视网膜会有不同程度的出血、渗出和黄斑水肿,视力下降,看不清远处的物体和眼前黑影。到了晚期视网膜会大量出血,视力骤然下降,甚至发生新生血管性青光眼,出现眼痛伴头痛,可能会导致完全失明。
在Ⅱ型糖尿病小鼠模型的研究中,发现了良好的肠道微生态环境可以改善DR。间歇性禁食(IF)既能诱导肠道细菌种类从拟杆菌转变为厚壁菌,又能减少视网膜小胶质细胞的影响和外周免疫细胞向视网膜的渗透,并增加小鼠的总生存率。厚壁菌门属可以将初级胆汁酸代谢为次级胆汁酸,如牛磺酸脱氧胆酸(TUDCA),一种在大鼠视网膜神经元中具有保护作用的化合物。
在糖尿病大鼠视网膜实验中探索了TUDCA改善DR结果的机制。TUDCA可降低糖尿病大鼠模型中免疫介质和血管生成因子(如一氧化氮合酶、ICAM-1、NF-κB p65和VEGF)的表达。在用高葡萄糖浓度培养的大鼠视网膜神经元中,TUDCA通过减少线粒体中凋亡诱导因子的释放和减少氧化损伤来降低细胞死亡率。同时有动物实验证明TUDCA的受体TGR5可以在DR病理中起作用。
总结来说就是IF可将肠道微生物群落向厚壁菌群转移,从而增加胆汁酸代谢和TUDCA产量,TUDCA可能在预防DR进展中发挥多种作用,例如减轻炎症和预防视网膜病变DR中的细胞死亡。
老年性黄斑变性
年龄相关性黄斑变性(AMD)是一种复杂的问题,越来越多的人受到折磨。饮食、年龄、代谢组和肠道微生物群之间存在着很强的相互作用,这些都在AMD的发病机制中发挥了作用。
来自同一组的两项病例对照研究发现,AMD患者的粪便含较多的与高脂饮食和炎症相关的细菌类群(如厌氧菌属),而拟杆菌在减少,这与保护自身免疫性疾病和不消化碳水化合物的发酵有关。
作者发现了C3−/−小鼠(有对老年视网膜产生负面影响的遗传背景)的补体系统和肠道微生物组变化之间的联系,包括厚壁菌与拟杆菌比例的增加和梭状芽孢杆菌的丰度增加。在我们人类中,类似的肠道微生物组变化与补体因子H基因单核苷酸多态性相关,表明补体缺乏、特定的肠道微生物组变化和AMD之间存在关系。代谢途径推断表明AMD患者的肠道脂肪酸延长率降低,L-丙氨酸发酵、谷氨酸降解和精氨酸生物合成增加,这可能影响视网膜健康。
有学者对这些研究进行了验证,发现喂高脂肪饮食的野生型小鼠在应对实验性激光损伤时,会影响脉络膜新生血管的形成,并以拟杆菌门为代价增加厚壁菌门肠道细菌的比例,同时肠道渗透性及全身性和脉络膜炎症也增加。通过粪便移植使肠道菌群正常化,也恢复了正常饮食水平的激光诱导脉络膜新生血管,无论饮食如何,这表明肠道微生物群是饮食诱导脉络膜血管生成增加的必要介质。
这些结果表明,肠道微生物的变化可能是AMD发病机制的一个因素。其机制可能包括通过受损的肠粘膜屏障渗透抗原、脂质或神经递质的细菌代谢物或膳食维生素或微量营养素的生物利用度而增加全身炎症。
原发性开角型青光眼
青光眼是一组由于眼压升高,或者是其他因素造成的视神经不可逆性损伤的眼病。比较常见的是原发性开角型青光眼(POAG)。关于微生物群对青光眼眼内病理学的影响的研究已经加速,通常集中在自身免疫或炎症方面。
对30名POAG患者和30名健康人群进行对照研究,发现了其肠道微生物的代谢差异。作者发现,POAG患者的粪便样本中大肠杆菌和普雷沃菌科相对丰富,而普通拟杆菌和巨单胞菌相对减少。
关于作用机制,文中提到了两方面,一是口腔微生物群与青光眼之间的联系。研究发现幽门螺旋杆菌感染会通过全身炎症、血管活性和活性氧种类增加或抗原抗体的交叉反应而加重青光眼。有学者于2000年发现青光眼与肠道微生物群的相关性,当时组织学证实88%的POAG患者中发现胃幽门螺杆菌感染。在POAG患者的小型试验中,成功根除幽门螺杆菌感染可以改善眼压和视野,但在无POAG的消化性溃疡患者中根除幽门螺旋杆菌感染并不能改变POAG的风险。目前仍然没有足够的证据来确定其是否存在因果关系。随后对POAG肠道微生物群的研究表明,肠道菌群失调是幽门螺旋杆菌感染和POAG的危险因素。
二是肠道微生物介导的对热休克蛋白的免疫应答。1998年,在POAG患者的血清中发现了热休克蛋白的自身抗体,随后试图研究其在青光眼发病机制中的作用。热休克蛋白具有免疫原性和高度保守性,对共生细菌热休克蛋白同系物的耐受性丧失,被认为是许多自身免疫性和神经退行性疾病的原因。2018年,就有研究发现,眼内压(IOP)的升高可以诱导T细胞渗入视网膜,这种T细胞渗入导致视网膜神经节细胞变性,即使在IOP恢复到正常水平后变性仍然持续存在,但无菌小鼠不会发生青光眼T细胞渗入反应及神经节细胞的变性,提示共生菌群引发的T细胞浸润在青光眼的发病机制中可能有重要作用。
目前,对肠道微生物群和眼部健康的研究面临着一个令人兴奋的前景。维持健康的肠道和肠道菌群,在某种程度上可以帮助我们保护眼睛健康;同时,某些营养也是眼睛健康所需要的,这些营养的正常吸收也离不开健康的肠道和肠道菌群。
参考文献:
[1] [美]乔希•阿克斯.吃土[M],王凌波,北京联合出版公司,2018.
[2] Patrick Donabedian.Gut Microbes and Eye Disease[J].Ophthalmic Research 2022;65:245–253.
[3] Maria B.Grant.Inside out: Relations between the microbiome, nutrition, and eye health[J].Experimental Eye Research 224 (2022) 109216




