糖尿病(DM)属于慢性代谢性疾病,按其发病机制分为I型糖尿病(T1DM)和II型糖尿病(T2DM)。I型糖尿病被归类为一种自身免疫性疾病;II型糖尿病是一种代谢综合征,其特征是胰岛素分泌绝对或相对不足,靶器官对胰岛素的敏感性降低。大多数糖尿病患者属于II型糖尿病。

近年来,糖尿病受试者的微生物菌群、肠道屏障和肠道代谢物的丰度与正常受试者相比存在显著差异。为了进一步了解糖尿病与肠道菌群之间的关系,本文综述了II型糖尿病与肠道菌群之间的相互作用机制。
一、肠道微生物组成与糖尿病
II型糖尿病患者肠道菌群的浓度、比例和功能与健康受试者有所不同。
在一项对36名成人受试者的研究中,双歧杆菌水平在健康人群中较高,而乳酸菌水平在II型糖尿病患者中显著升高。此外,该研究还报道了与健康受试者相比,II型糖尿病患者肠道中梭状芽孢杆菌,嗜黏蛋白阿克曼菌均减少。
Huang等报道,当血糖升高时,肠球菌的水平升高,而普通双歧杆菌和其他双歧杆菌的水平降低,进一步导致糖尿病的加重。同时还在糖尿病患者的肠道中发现一些条件致病菌明显增加,如拟杆菌,大肠杆菌和脱硫弧菌。
He等人发现拟杆菌与II型糖尿病呈负相关。II型糖尿病患者中拟杆菌、普通拟杆菌和肠拟杆菌均下降。
二、肠道菌群代谢物与糖尿病
肠道微生物群被认为是一种代谢器官,产生大量的代谢物(短链脂肪酸、胆汁酸、吲哚衍生物等),这些代谢物通过其同源受体发出信号来调节宿主的代谢。
(1)短链脂肪酸(SCFAs)
既往研究报道,糖尿病患者中产生短链脂肪酸的细菌减少,导致SCFAs的生成减少。这些减少的SCFAs可以影响上调的肠道抗炎反应,削弱短链脂肪酸受体的激活。短链脂肪酸受体属于G-蛋白偶联受体(GPCR)家族,包括GPR41和GPR43,被SCFAs激活后发挥脂肪代谢、糖代谢、肽酪氨酸酪氨酸(PYY)产生等重要生理功能,调节肠道运动和营养吸收。
此外,菌群失衡也会削弱GPR43的功能,特别是在调节脂肪-胰岛素信号通路方面,导致能量消耗减少,胰岛素分泌减少
在各种短链脂肪酸中,丁酸尤其受到广泛关注。一些研究表明,葡萄糖代谢受损与糖尿病患者中产生丁酸盐的细菌水平下降有关。丁酸可以通过刺激胰高血糖素样肽-1(GLP-1)的分泌来调节结肠调节性T细胞池的大小和功能,提高胰岛素敏感性,降低脂肪细胞的炎症反应。
(2)胆汁酸
胆汁酸作为控制葡萄糖稳态的信号分子,由肝细胞产生,分泌到肠道中,促进膳食脂质的吸收。胆汁酸可有效增加糖尿病患者中乳酸杆菌等益生菌的比例,降低大肠杆菌、沙门氏菌等条件致病菌的水平。
肠道菌群通过胆汁酸盐和7α-脱氢酶将初级胆汁酸代谢为次生胆汁酸。当胆汁酸受体被激活时,它就会激活一系列细胞核受体,这些受体调节肠促胰岛素激素GLP-1的分泌,减少糖异生,增加能量消耗,刺激胰腺胰岛素分泌,减轻免疫细胞的炎症。

三、肠屏障与免疫
肠道屏障由肠上皮屏障、肠黏液屏障和肠血管屏障组成。肠上皮固有层中的免疫细胞,如树突状细胞、 潘氏细胞、淋巴细胞和巨噬细胞,可分泌多种细胞抗菌IgG、多肽和细胞因子,共同维持肠道免疫稳态。
如果肠道屏障的完整性受损,就会发生严重的全身炎症和代谢性疾病。脂多糖(LPS)可以通过肠道渗漏或乳糜微粒携带穿过肠上皮屏障。糖尿病患者的炎症反应可能与肠通透性增加引起的LPS含量增加有关。
此外,宿主先天免疫系统在肠道微生物和糖尿病中发挥作用。
髓系分化因子-88(Myd88)是大多数TLRs和IL-1受体介导的信号通路的下游靶点,在先天免疫信号中起重要作用。据报道,肝细胞特异性缺失MyD88可使小鼠易发生葡萄糖耐受不良、炎症、肝胰岛素抵抗和诱导肠道微生物群改变。此外,促炎细胞因子,如单核巨噬细胞趋化因子蛋白-1(MCP-1)和干扰素-γ(INF-γ)也与II型糖尿病的发生相关。
因此,肠道屏障完整性受损和自身免疫性失衡在不同程度上均影响糖尿病的发生。
四、肠道激素、肠道微生物群和糖尿病
肠道激素是由肠内分泌细胞(EECs)产生和分泌的。EECs的功能受肠道微生物群的调节,肠道微生物群的组成和多样性极大地影响了肠道激素的释放,包括胆囊收缩素(CCK)、肽酪氨酸酪氨酸(PYY)、胰高血糖素样肽-1(GLP-1)和抑胃肽。
GLP-1和PYY是由肠内分泌L细胞分泌。它们能促进饱腹感,抑制能量摄入。GLP-1主要在碳水化合物和脂肪的作用下释放。肠道激素(GLP-1、P物质、脂联素和瘦素)可能与糖尿病的发生直接或间接相关。II型糖尿病患者的血清脂联素水平明显低于健康人群。
肠道菌群与糖尿病的相互作用机制见图1
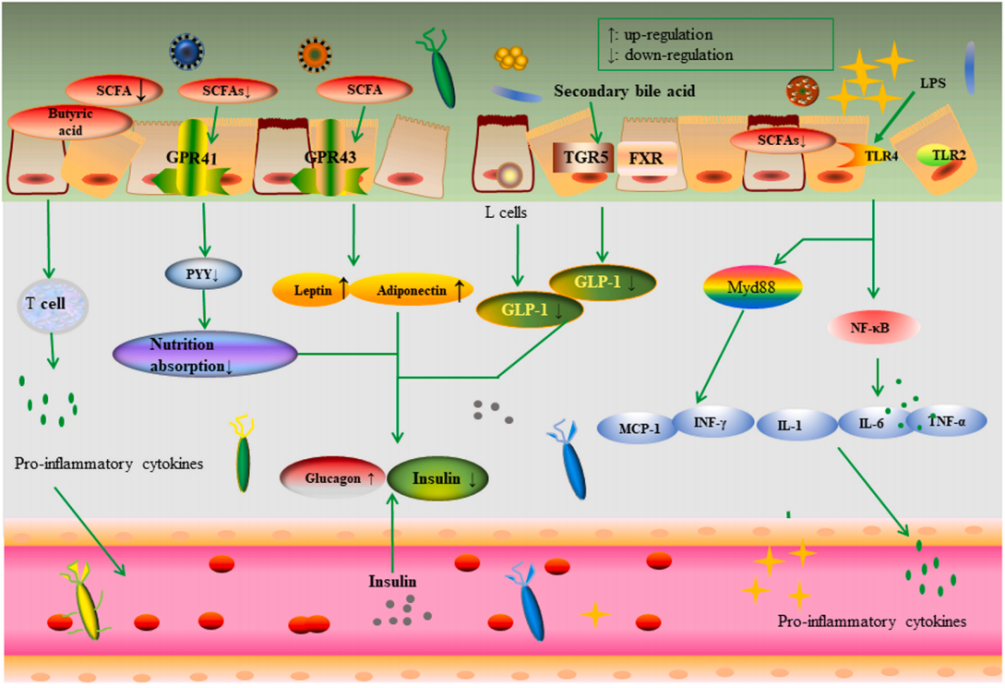
图1 肠道菌群与糖尿病的相互作用机制
PYY,肽酪氨酸酪氨酸;GLP-1,胰高血糖素样肽-1;GPR G,蛋白偶联受体;INF-γ,干扰素γ;IL,白细胞介素;LPS,脂多糖;MCP-1,巨噬细胞趋化因子蛋白1;SCFAs,短链脂肪酸TL,Toll样受体。
五、肠道微生物群、mTOR 和糖尿病
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是细胞生长和增殖的重要调节因子。
哺乳动物靶雷帕霉素1(mTORC1)可以促进合成代谢过程,如蛋白质和脂质生物合成,也会抑制分解代谢过程,如自噬。其活性受生长因子、胰岛素和能量可利用率(AMP/ATP比值)的调节。它的过度激活可导致糖尿病、炎症和神经退行性疾病。
微生物群分泌的代谢产物,如SCFAs,调节宿主的许多功能,主要是自噬和脂质代谢。许多这些作用都是通过mTOR通路介导的。相反地,mTOR通路通过控制肠道屏障功能来影响肠道微生物群的组成。
此外,肠道菌群可调节mTORC信号通路,从而抑制酪氨酸磷酸化,降低蛋白水平,下调胰岛素信号转导,发挥肠道微生物对糖尿病的影响。
Nakamura等人发现,胰岛素刺激的近端小管钠转运是通过Akt2/mTORC2通路介导的,而胰岛素抑制的近端小管糖异生是通过IRS1/Akt2/mTORC1/2通路介导的。
mTOR通路之间的相互作用机制如图2
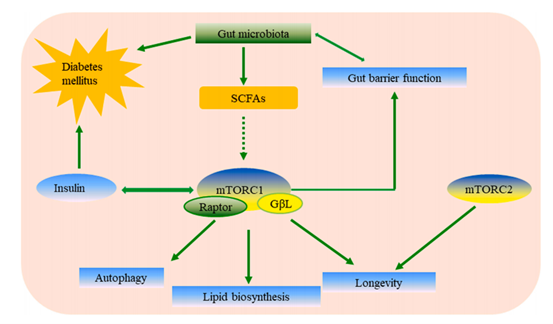
图2 mTOR通路与肠道菌群的相互作用机制
通过上述肠道菌群影响II型糖尿病的机制,该篇文献中还对通过肠道菌群治疗糖尿病的天然化合物进行了分类和总结。我们下期与大家分享。
文献来源:liying he , Fang-Qing Yang , Pan Tang,et al. Regulation of the intestinal flora: A potential mechanism of natural medicines in the treatment of type 2 diabetes mellitus[J].Biomedicine &Pharmacotherapy,(151)2022.
(文章摘取自科普文献 不做任何医学指导)




