动物双歧杆菌乳亚种IOB-LO7与阿尔兹海默病
阿尔茨海默病,对很多人来说并不陌生,但对它的认识或许大多只停留在“会忘记很多事”。事实上阿尔茨海默病不仅仅是“失去记忆”四个字可以潦草概括的,除了被熟知的“脑海中的橡皮擦”,阿尔茨海默病还表现为认知、语言、行为等全面性的痴呆……
目前我国约有 1000 万阿兹海默病患者,预计到 2050 年,这一数字将达到 4000 万[1]。AD(阿兹海默病)及相关痴呆是我国第五位死亡原因,已成为严重影响我国人口健康的重大公共卫生问题。
今天,我们邀您一起走进阿尔茨海默病,认识、理解每一个“困在时间里的人”。

阿尔茨海默病的症状
阿尔茨海默病为常见中枢神经系统慢性退行性疾病,阿尔茨海默病患者一般具有认知障碍、行为障碍、记忆衰退、语言障碍、人格改变等症状,给患者、家庭和社会带来了沉重的精神和经济负担。目前,在我国痴呆症患者数量巨多,60岁及以上人群痴呆患者约1507万,其中阿尔茨海默病患者达983万,占痴呆患者的65.23%。9月20日,《阿尔茨海默病患者需求洞察报告》正式发布,“忆起向未来——阿尔茨海默病患者需求圆桌讨论会”在北京举办。《报告》显示,我国阿尔茨海默病患者呈现年轻化的增长趋势。
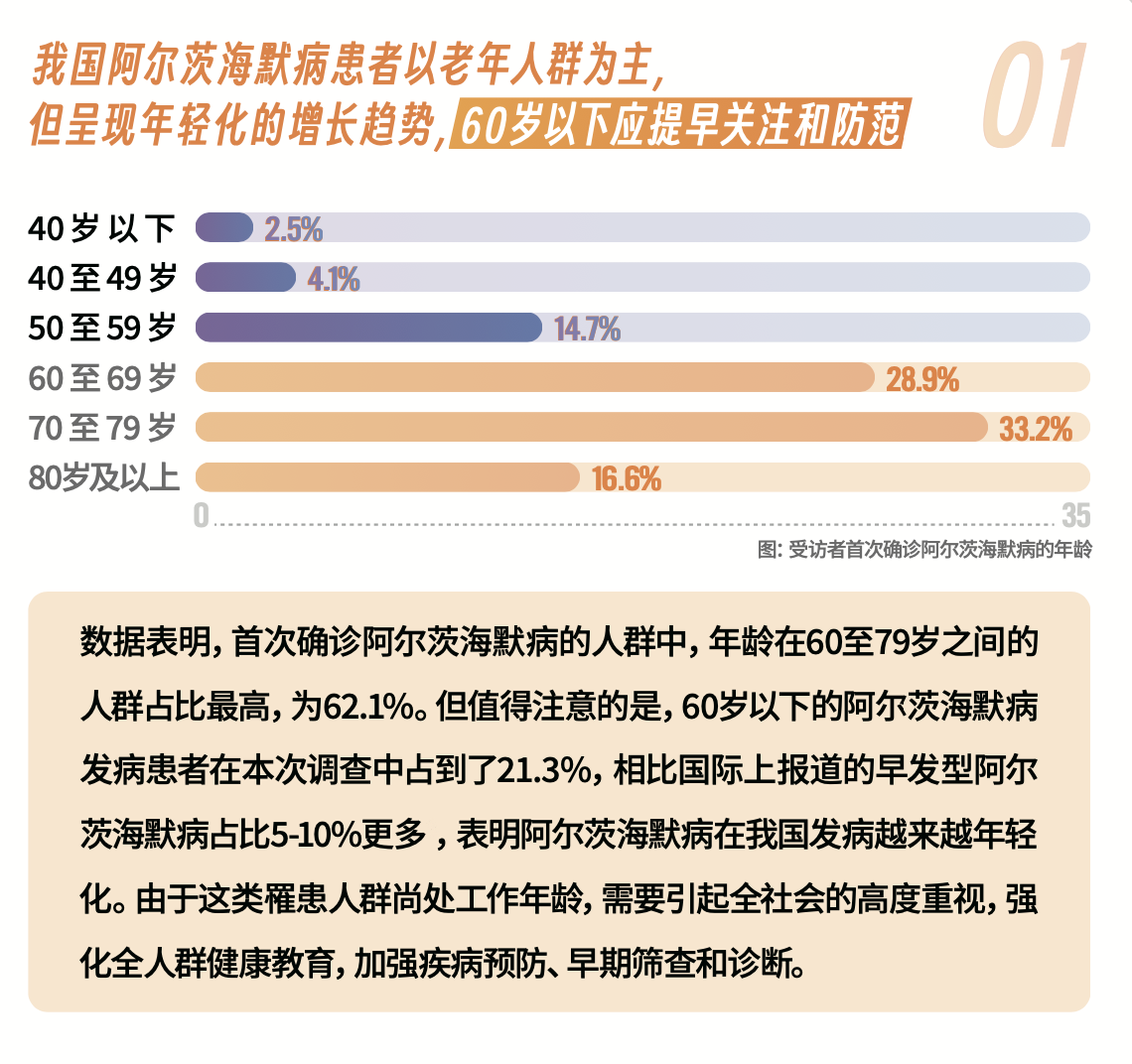
图片来源于:人民网·人民健康与中国老年保健协会阿尔茨海默病分会(ADC)联合发布的
《阿尔茨海默病患者需求洞察报告》
阿尔茨海默病的发病是由多方面的神经损伤导致的,如Aβ聚集、tau蛋白过度磷酸化、氧化应激、炎症反应等导致的神经损伤。阿尔茨海默病患者神经病理表现主要包括细胞外老年斑(SP)、细胞内神经元纤维缠结(NFTs)、神经突触丧失,以及小胶质细胞及星形胶质细胞介导的神经炎性反应加剧等。

阿兹海默症病状
淀粉样蛋白沉积是阿尔茨海默病的最核心病理学表征,其在脑部堆积形成斑块会引发一系列的神经炎症,也会通过脑-肠轴之间的双向作用,导致肠道菌群结构发生变化。近年来,有一种假说认为阿尔茨海默病的发病可能与肠道微生物的失调有关。肠道菌群紊乱会引起菌群代谢产物失调,例如脂多糖(LPS)、细菌淀粉样蛋白,细菌淀粉样蛋白和LPS能破坏肠道屏障,导致肠道屏障通透性增加。细菌来源的LPS和淀粉样蛋白穿过受损的肠道黏膜,通过血流到达中枢神经系统,增加Aβ聚集物的成核并触发一系列炎症反应,进而可能损伤血脑屏障,引起神经炎症和神经损伤,导致神经变性,从而形成阿尔茨海默病。
益生菌与阿尔茨海默病
益生菌已被证明可以恢复肠道微生物群的稳态,延缓阿尔茨海默病的进展,特别是炎症反应,从而改善认知能力下降[2,3]。灭活益生菌可以通过刺激宿主黏膜免疫反应来影响宿主肠道微生物群,因此通过益生菌或后生元进行干预被认为是预防阿尔茨海默病认知能力下降的最佳措施之一[4]。
鉴于现有技术中存在的技术问题,创源生物提供一种降低Aβ42沉积的动物双歧杆菌乳亚种IOB-LO7及其应用,并申请中国发明专利[5]。
提供的动物双歧杆菌乳亚种IOB-LO7,分类命名为Bifidobacterium animalis subsp.lactis,该菌通过降低大鼠大脑皮层和海马体中42.1-64.9%的Aβ42的含量,很大程度上减少Aβ42在脑组织中的聚集,一方面清除Aβ淀粉样斑块,大大改善了神经元之间的通信,有助于恢复认知功能;另一方面,降低了Aβ42在脑组织中的积累引发的大脑炎症反应,减少了对神经细胞的损伤;同时,减少Aβ42浓度极大改善了突触传递,神经网络的正常功能恢复速度加快,有效改善了阿尔兹海默病。该菌还能调节肠道菌群代谢产物失调,减轻大鼠肠黏膜屏障损伤,提高肠道屏障通透性,阻止LPS等有害代谢物的释放和扩散,减少Aβ聚集物的成核,以保护神经系统,减少大脑神经炎症反应。
1.大鼠行为学探究实验
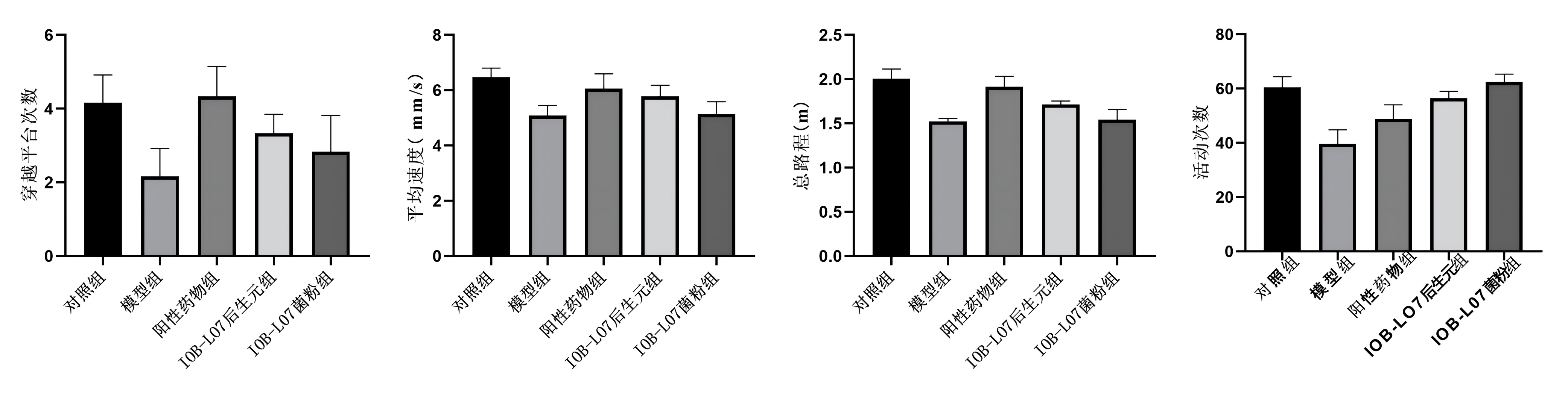
与模型组相比,IOB-LO7菌粉组、IOB-LO7后生元组穿越平台的次数、平均速度、总路程、活动次数显著性提高。综上实验结果表明,动物双歧杆菌乳亚种IOB-LO7可以改善D-半乳糖/AlCl3诱导的阿尔兹海默病大鼠焦虑样行为。
2.大鼠脑部Aβ42浓度及Aβ淀粉样斑块的清除情况
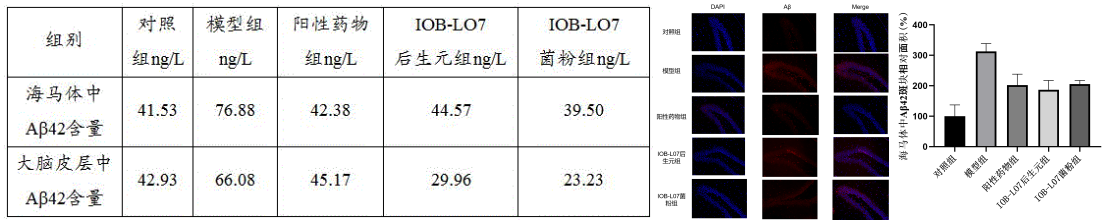
与模型组相比,IOB-LO7菌粉组、IOB-LO7后生元组海马体内、大脑皮层中Aβ42沉积数量显著性降低,其中菌粉组分别降低了42.1%、54.6%,后生元组降低了48.6%、64.9%。综上实验结果表明,动物双歧杆菌乳亚种IOB-LO7可降低阿尔茨海默病大鼠脑部Aβ42含量。
经过为期3个月的干预后,IOB-LO7菌粉组、IOB-LO7后生元组大鼠海马体内Aβ42的表达程度有所降低,海马体中Aβ42的斑块面积显著减少,其中菌粉组降低了34.3%,后生元组降低了40.2%。
3.大鼠脑部神经炎症改善情况
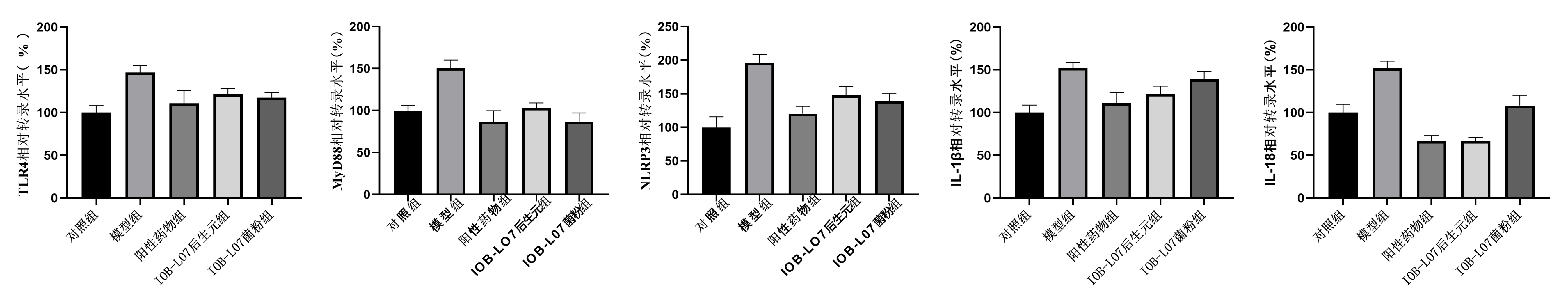
Toll样受体4(TLR4)是一种I型跨膜受体,具有感知大脑中外源性病原体和内源性炎症刺激的能力,其中包括Aβ、LPS等。TLR4/NLRP3/MyD88信号可以触发大脑中的炎症反应,从而促进诱导核因子B的转录活性,并最终导致促炎因子IL-1β和IL-18的表达。通过测定大鼠脑组织中NLRP3、MyD88、IL-1β、IL-18基因相对转录水平,来观察TLR4信号通路相关基因的表达模式以及转录因子的激活程度。
与模型组相比,IOB-LO7菌粉组、IOB-LO7后生元组显著下调了TLR4、NLRP3、MyD88、IL-1β、IL-18相关基因的表达,后生元组IL-1β和IL-18相关基因的表达量降低了19.7%和56.2%,菌粉组降低了9.4%和28.8%。
综上实验结果表明,动物双歧杆菌乳亚种IOB-LO7能够抑制TLR4/MyD88/NLRP3信号通路,缓解阿尔兹海默病大鼠的神经炎症。
4.大鼠肠道损伤改善情况
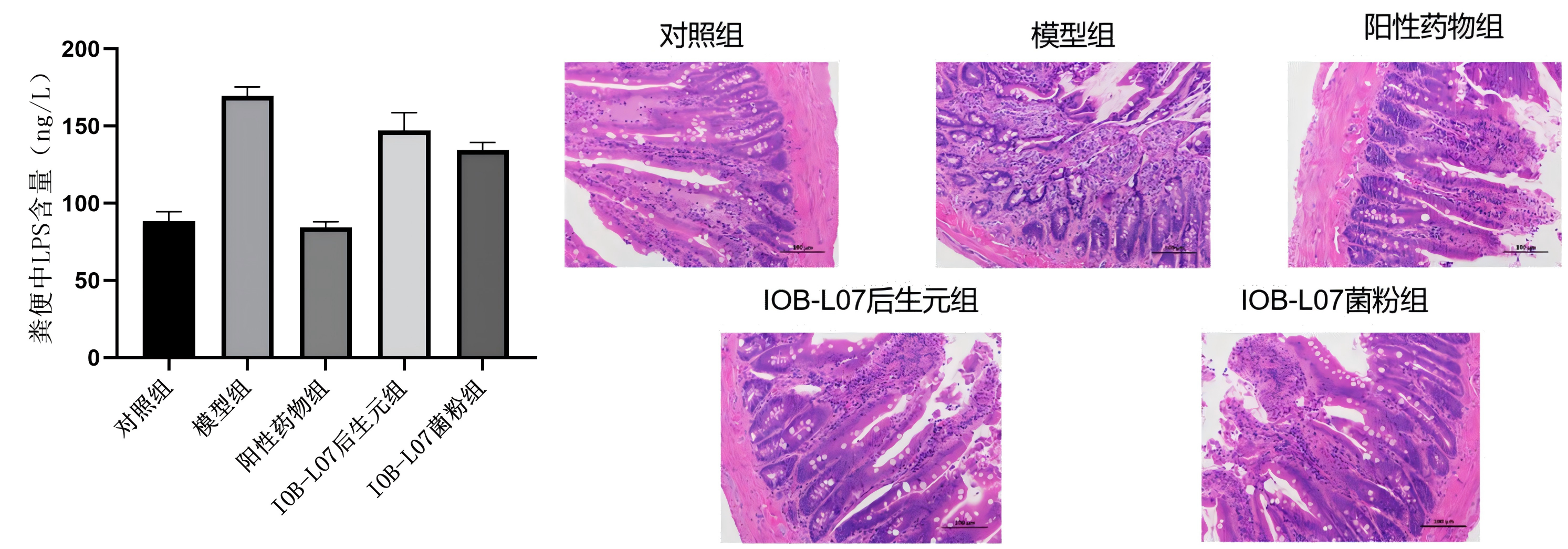
与模型组相比,IOB-LO7菌粉组、IOB-LO7后生元组LPS含量均呈现下降的趋势;进一步分析了大鼠的小肠组织病理切片,观察大鼠肠道组织形态结构的变化。模型组大鼠的小肠绒毛明显截短甚至萎缩,排列稀疏,组织结构比较混乱,经过菌粉和后生元干预之后,各组大鼠虽然结肠顶部的绒毛略有脱落,但底部绒毛的长度有所增加,组织结构较为清晰。可以看出后生元能够在一定程度上改善AD大鼠的小肠组织形态,有效维护小肠黏膜结构,对小肠组织形态损伤具有一定的保护作用。
综上实验结果表明,动物双歧杆菌乳亚种IOB-LO7可以减轻AD大鼠肠黏膜屏障损伤,阻止LPS等有害代谢物的释放和扩散。
参考文献:
[1] JIA L, DU Y, CHU L, et al. Prevalence, risk factors, and management of dementia and mild cognitive impairment in adults aged 60 years or older in China: a cross-sectional study [J]. Lancet Public Health, 2020, 5(12): e661-e71.
[2]Loh S J,Mak Q W,Tan S K L, et al.Microbiota-gut-brain axis and its therapeutic applications in neurodegenerative diseases[J].Signal transduction and targeted therapy,2024,9(1):37-37.
[3]Zhongci H ,Tong L ,Zehua Z , et al.Composition of intestinal flora affects the risk relationship between Alzheimer's disease/Parkinson's disease and cancer[J].Biomedicine & Pharmacotherapy,2022,145112343-112343.
[4]Agustina G B,Gabriel P C,Romina J N, et al.Improvement of Key Molecular Events Linked to Alzheimer's Disease Pathology Using Postbiotics.[J].ACS omega,2023,8(50):48042-48049.
[5]中国发明专利,专利号:ZL 202411230717.5
部分文章摘取自科普文献 不做任何医学指导

动物双歧杆菌乳亚种IOB-LO7,后生元
相关新闻


